
Công thức tính thành phần phần trăm theo khối lượng và thể tích
Công thức tính thành phần phần trăm theo khối lượng và thể tích được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
I. Nồng độ là gì?
Nồng độ là khái niệm để biểu thị lượng hóa chất có trong một hỗn hợp, đa phần là dung dịch. Một số khái niệm nồng độ hay gặp là:
- Nồng độ phần trăm
- Nồng độ mol
- Nồng độ molan: Biểu thị số mol của 1 chất cho trước trong 1kg dung môi
- Nồng độ chuẩn: Thường dùng cho những phản ứng và dung dịch axit - bazo
- Nồng độ chính tắc: Là cách đo nồng độ tương tự như nồng độ mol và rất hiếm khi dùng
II. Nồng độ phần trăm là gì?
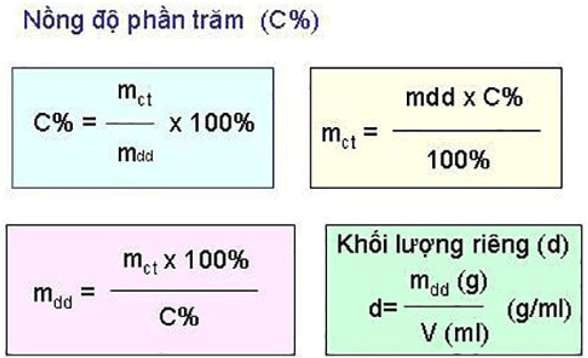
Nồng độ phần trăm biểu thị số gam chất tan có trong 100g dung dịch và được ký hiệu là C%.
1. Công thức tính nồng độ phần trăm C% theo khối lượng
Phần trăm khối lượng là gì?
- Phần trăm khối lượng sẽ cho biết tỷ lệ phần trăm của mỗi nguyên tố trong hợp chất hóa học.
- Muốn tìm phần trăm khối lượng, ta cần biết khối lượng mol của các nguyên tố trong hợp chất theo gam/mol hay số gam của các chất tạo thành dung dịch.
- Phần trăm khối lượng được tính với một công thức đơn giản, đó là lấy khối lượng của nguyên tố (hay chất tan) chia cho khối lượng của hợp chất (hay dung dịch).
Phần trăm theo khối lượng (m / m) là khối lượng chất tan chia cho tổng khối lượng của dung dịch, nhân với 100%.
Phần trăm theo khối lượng = khối lượng chất tan/tổng khối lượng dung dịch ×100%
Công thức tính C% trong hóa học:
Trong đó:
- C%: Ký hiệu của nồng độ phần trăm
- mct: Ký hiệu của khối lượng chất tan
- mdd: Ký hiệu của khối lượng dung dịch
Công thức tính mdd:
mdd = mct + mdm (trong đó mdm là khối lượng của dung môi)
Ví dụ
Phần trăm khối lượng của dung dịch chứa 26,5 g glucose trong 500 g dung dịch là bao nhiêu?
Dung dịch
Phần trăm theo khối lượng = khối lượng glucose/tổng khối lượng dung dịch×100% = 26,5g
500g × 100% = 5,30%
2. Công thức tính nồng độ phần trăm C% theo thể tích
- Phần trăm theo thể tích (v / v) là thể tích chất tan chia cho tổng thể tích dung dịch, nhân với 100%.
- Phần trăm theo khối lượng = thể tích chất tan/tổng thể tích dung dịch × 100%
Ví dụ
Làm thế nào bạn sẽ chuẩn bị 250 ml 70% (v / v) rượu xát
Dung dịch
70% = thể tích cồn xát/tổng thể tích dung dịch ×100% × 100%
Vì thế
Thể tích cồn xát = thể tích dung dịch × 70%/100% = 250 ml × 70/100= 175 ml
Bạn sẽ thêm đủ nước vào 175 ml rượu xát để tạo ra tổng cộng 250 ml dung dịch.
III. Các bước giải bài tập tính nồng độ phần trăm
Các dạng bài tập tính nồng độ phần trăm trong hóa học rất đa dạng, nhưng chúng đều phải thực hiện giải theo các bước sau đây:
- Bước 1: Khi đọc đề bài chúng ta cần phải xác định được số chất có trong dung dịch, nhất là các số dư của chất tham gia phản ứng.
- Bước 2: Tính khối lượng dung dịch sau khi tham gia phản ứng theo phương pháp bảo toàn khối lượng (tổng khối lượng chất tham gia phản ứng = tổng khối lượng sản phẩm).
- Bước 3: Tính mct
- Bước 4: Áp dụng công thức tính nồng độ phần trăm để giải quyết bài toán.
Áp dụng đúng 4 bước trên đây là bạn hoàn toàn có thể tính nồng độ phần trăm rồi. Tuy nhiên, có nhiều bài tập nó không cho sẵn khối lượng của các chất nên ta cần phải áp dụng các kiến thức hóa học đã được học kết hợp với công thức tính nồng độ phần trăm để giải bài toán nhé.
Bài tập tính nồng độ phần trăm của dung dịch
Bài 1: Bạn hãy tính khối lượng của NaOH có trong 200g dung dịch NaOH 15%
Lời giải:
Áp dụng công thức C% = (mct/mdd).100% ta có:
C% = (mNaOH/200).100 = 15 (%)
=> mNaOH = (15.200)/100 = 30 (g)
Trong đó:
- (.) ký hiệu dấu nhân
- (/) ký hiệu dấu chia
Kết luận: Vậy trong 200g dung dịch NaOH 15% có 30 gam NaOH
Bài 2: Tiến hành hòa tan 20 gam muối vào nước thu được dung dịch A có C% = 10%
a, Hãy tính khối lượng của dung dịch A thu được
b, Hãy tính khối lượng nước cần thiết cho sự pha chế
Lời giải:
a, Áp dụng công thức C% = (mct/mdd).100% ta có:
mdd =(mmuối.100)/ C% = (20.100)/10 = 200 gam
Kết luận: Vậy khối lượng dung dịch A là 200 gam
b, Áp dụng phương pháp bảo toàn khối lượng ta có mnước = mdd - mmuối = 200 - 20 = 180 gam
Kết luận: Vậy để có thể hoàn tan 20 gam muối thì chúng ta phải cần 180 gam nước để tạo ra 200 gam dung dịch
Bài 3: Tiến hành hòa tan 3,9 gam Kali vào 36,2 gam nước chúng ta thu được dung dịch B có nồng độ bao nhiêu?
Lời giải:
Ta có phương trình phản ứng hóa học sau
2K + 2H2O → 2KOH + H2
Số mol của K = 3,9/ 39 = 0,1 => mol KOH = 0,1 => mol H2O = 0,05
Theo cân bằng phương trình ta tính được:
mdd = mk + mH2O - mH2 = 3,9 + 36,2 - (0,05.2) = 40 gam
=> Áp dụng công thức C% = (mct/mdd).100% ta có C% = [(0,1.56)/40].100% = 14%
Kết luận: Khi tiến hành hòa tan 3,9 gam Kali vào 36,2 gam nước ra sẽ thu được dung dịch có nồng độ 14%.
IV. Một số lưu ý khi tính nồng độ phần trăm của dung dịch
- Phải đọc đề kĩ để biết được chính xác các thành phần đã cho, xác định được cần tính toán những thành phần nào.
- Áp dụng đúng công thức tính để tránh những sai lầm không cần thiết.
- Tính các dữ liệu phải cẩn thận, tránh các sai sót không đáng có.
V. Nồng độ mol khác nồng độ phần trăm như thế nào?
Nồng độ Mol là gì?
Nồng độ mol của dung dịch cho chúng ta biết số mol chất tan có trong 1 lít dung dịch là bao nhiêu.
1. Công thức tính nồng độ mol theo khối lượng
Trong đó:
- n: ký hiệu số mol
- m: khối lượng của chất đó
- M: Khối lượng mol của chất đó (có sẵn trong bảng tuần hoàn hóa học)
- V: Thể tích (đktc)
2. Cách tính nồng độ mol
Nồng độ mol có ký hiệu là CM và được tính theo công thức
C M = n/V dd
- CM: ký hiệu của nồng độ mol
- n: Ký hiệu số mol chất tan
- Vdd: Ký hiệu thể tích dung dịch
VI. Mối quan hệ giữa nồng độ phần trăm và các nồng độ dung dịch khác
Giữa nồng độ phần trăm và nồng độ mol
C M = (10 x d x C%) / M
Trong đó:
- M: khối lượng phân tử chất tan.
- CM: nồng độ mol của dung dịch.
- d: khối lượng riêng của dung dịch.
- C%: nồng độ phần trăm của dung dịch.
Giữa nồng độ phần trăm và nồng độ đương lượng
C N = (10 x d x C%) / D
Trong đó:
- D: đương lượng gam
- d: khối lượng riêng của dung dịch.
- CN: nồng độ tương đương của dung dịch
- C%: nồng độ phần trăm của dung dịch.
-
Như vậy VnDoc đã giới thiệu các bạn tài liệu Công thức tính thành phần phần trăm theo khối lượng và thể tích. Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8
Link nội dung: https://truyenhay.edu.vn/phan-tram-the-tich-a68375.html