
Hidroxit lưỡng tính là gì? Hiđroxit nào sau đây có tính chất lưỡng tính? Đây là hai câu hỏi VIETCHEM nhận được nhiều nhất trong những ngày ôn thi đại học vừa qua. Bài viết dưới đây sẽ giải thích chi tiết về Hidroxit lưỡng tính và các ví dụ thực tế để các bạn học sinh có thể ứng dụng vào làm bài thi một cách tốt nhất.
1. Định nghĩa Hidroxit lưỡng tính là gì?
1.1. Hidroxit là gì?
Hidroxit là tên gọi của anion nhị nghuyên tử kí hiệu OH-, được kết hợp bởi một nguyên tử oxy và một nguyên tử hydro. Trong các hợp chất vô cơ chứa nhóm OH- được gọi chung là các hidroxide. Phần lớn các hợp chất chứa hidroxide đều thể hiện tính chất của một base.
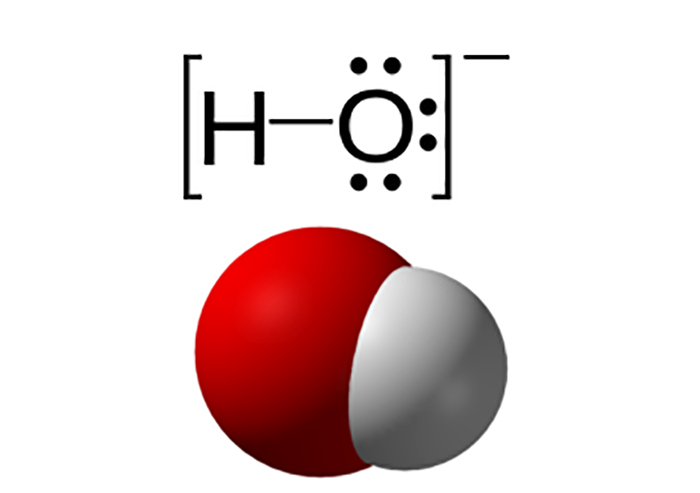
Hidroxit được liên kết bởi một và một nguyên tử hydro
1.2. Hidroxit lưỡng tính là gì?
Hidroxit lưỡng tính là Hidro khi tan trong nước sẽ vừa có thể phân li như một bazo nhưng cũng vừa có thể phân li như một axit.
Ví dụ: Zn(OH)2 được gọi là một Hidroxit lưỡng tính, khi phân li trong nước có những hiện tượng sau:
- Phân li như một aixit: Zn(OH)2 Zn2+ + 2OH-
- Phân li như một bazo: Zn(OH)2 ZnO22- + 2H+
Zn(OH)2 là một Hidroxit lưỡng tính
>>>XEM THÊM:: Phản ứng oxi hóa khử là gì?
2. Một số Hidroxit lưỡng tính
Trong hóa học, để biểu hiện tính Hidroxit lưỡng tính của Zn(OH)2 người ta sẽ viết công thức phân tử dưới dạng H2ZnO2.
Một số loại Hidroxit lưỡng tính thường gặp đó là: Zn(OH)2, Al(OH)3, Sn(OH)2, Pb(OH)2. Những loại Hidroxit lưỡng tính thường ít tan trong nước và có lực axit hoặc bazo yếu.
Ví dụ: Al(OH)3
- Phân li như một aixit: Al(OH)3 Al3+ + 3OH-
- Phân li như một bazo: Al(OH)3 Al2O33- + 3H+

Sau kết quả thí nghiệm cho ra một số Hidroxit lưỡng tính
3. Sự điện li của axit và bazo trong nước
Ở trên chúng ta đã có định nghĩa Hidroxit lưỡng tính là gì - Là Hidro khi tan trong nước sẽ vừa có thể phân li như một bazo nhưng cũng vừa có thể phân li như một axit. Tiếp đây, VIETCHEM sẽ giải thích cho các bạn chi tiết về sự điện li của axit và bazo trong nước diễn ra như thế nào.
3.1. Sự điện li của axit trong nước
Theo thuyết A-rê-ni-ut, axit khi tan trong nước sẽ phân li ra cation H+. Hầu hết các loại axit đều có một số tính chất chung và đều có tính chất của các cation H+. Axit nhiều nấc là những axit phân li nhiều lần ra H+
Ví dụ như sau:
HBr → H+ + Br-
CH3COOH ⇔ H+ + CH3COO-
Sự điện li của axit và bazo trong nước
3.2. Sự điện li của bazo trong nước
Theo thuyết A-rê-ni-ut, bazo khi tan trong nước sẽ phân li ra cation OH-. Hầu hết các dung dịch bazo có một số tính chất chung và đều có tính chất của các OH-.
Ví dụ như sau:
KOH → K+ + OH-
Ca(OH)2 → Ca2+ + 2OH-
4. Các dạng bài tập Hidroxit lưỡng tính là gì?

Các dạng bài tập Hidroxit lưỡng tính
Bài tập 1: Hãy viết phương trình điện li của các chất như sau:
a, Các loại axit yếu: H2S, H2CO3
b, Các loại bazo mạnh: LiOH
c, Hidroxit lưỡng tính: Sn(OH)2
Lời Giải:
a, Phương trình điện li của các axit yếu: H2S, H2CO3
H2S ⇔ H+ + HS-
HS- ⇔ H+ + S2-
H2CO3 ⇔ H+ + HCO3-
HCO3- ⇔ H+ +CO32-
b, Phương trình điện li của bazo mạnh: LiOH
LiOH → Li+ + OH-
c, Phương trình điện li của Hidroxit lưỡng tính: Sn(OH)2
- Phân li kiểu axit: Sn(OH)2 ⇔ SnO22- + H+
- Phân li kiểu bazo: Sn(OH)2 ⇔ Sn2+ + 2OH-
Bài tập 2: Theo thuyết A-re-ni-ut, định nghĩa nào sau đây là đúng?
A. Một hợp chất trong thành phần phân tử có hiđro là một axit.
B. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
C. Một hợp chất có khả năng phân li ra cation H+ trong nước là axit.
Lời Giải: Đáp án C đúng
A sai vì: axit khi phân li trong nước sẽ ra H+
B sai vì ancol có nhóm OH nhưng không phải một bazo
Bài tập 3: Viết phương trình điện li của H3PO4 trong nước
Lời Giải:
H3PO4 là axit ba nấc:
H3PO4 ⇌ H+ + H2PO4-
H3PO4 - ⇌ H+ + HPO42-
H3PO4 2- ⇌ H+ + PO43-
Bài tập 4: Chất nào sau đây là Hidroxit lưỡng tính?
A. Mg(OH)2
B. Zn(OH)2
C. NaOH
D. Fe(OH)2
Lời Giải: Đáp án đúng là B
Zn(OH)2 là một chất lưỡng tính, ngoài ta một số loại Hidroxit lưỡng tính khác đó là: Al(OH)3, Sn(OH)2, Cr(OH)3, Pb(OH)2
Bài tập 5: Trong dung dịch HNO3, bỏ qua sự phân li của nước, hãy xác định những phân tử của hóa chất này.
A. H+, NO3-
B. H+, NO3-, H2O
C. H+, NO3-, HNO3
D. H+, NO3-, HNO3, H2O
Lời Giải: Đáp án B đúng
Ta có phương trình điện li: HNO3 → H+ + NO3-
Bài tập 6: Hãy chọn các chất là Hidroxit lưỡng tính trong các chất dưới đây:
A. Zn(OH)2, Cu(OH)2
B. Al(OH)3, Cr(OH)2
C. Sn(OH)2, Pb(OH)2
D. Cả A, B, C.
Lời Giải: Đáp án D là đúng
Bài tập 7: Cho dãy ion dưới đây, hãy xác định đâu là dãy có tính chất lưỡng tính
A. Cl-, Na+, NH4+, H2O
B. ZnO, Al2O3, H2O
C. Cl-, Na+
D. NH4+, Cl-, H2O
Lời Giải: Đáp án B đúng
A sai do Na+, Cl- là các ion trung tính; NH4+ là ion có tính axit
C sai do Na+; Cl- đều là các ion trung tính.
D sai do NH4+ là ion có tính axit; Cl- là ion trung tính.
Hy vọng với những thông tin về Hidroxit lưỡng tính là gì trên đây sẽ giúp các bạn học sinh ứng dụng vào làm bài tập hiệu quả. Xem thêm các dạng bài tập khác trên website vietchem.com.vn của chúng tôi. Đừng quên chia sẻ bài viết nếu bạn thấy hay.
Link nội dung: https://truyenhay.edu.vn/chon-cac-chat-la-hidroxit-luong-tinh-trong-so-cac-hidroxit-sau-a65295.html